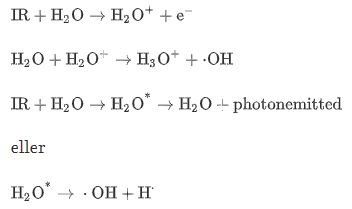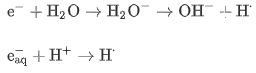HYDROGENTERAPI KAN SKYDDA DIG MOT TUMÖRTERAPI, WIFI OCH 5G STRÅLNING
Molekylärt väte = Ett potentiellt radioskyddsmedel visar forskningen
Abstrakt
Under senare år har många studier visat att väte har terapeutiska och förebyggande effekter på olika sjukdomar. Dess selektiva antioxidantegenskaper märktes väl. De flesta av de joniserande strålningsinducerade skadorna orsakas av hydroxylradikaler ( OH) från radiolys (radiolys är kemisk spjälkning av molekyler genom joniserande strålning). Eftersom väte kan mildra sådan skada genom flera mekanismer, uppvisar det en anmärkningsvärd potential som ett nytt radioskyddande medel. Denna granskning analyserar möjliga mekanismer för vätgas radioskyddande egenskaper och effektiva leveransmetoder. Vi tittar också på detaljer i vitro- och vivo- studier för vätgas radioskyddande effekter och kliniska praxis. Vi drar slutsatsen att väte har god potential för radioskydd, med bevis för att det finns ett större forskningsarbete på detta område.
1 . Introduktion
Väte är det vanligaste och lättaste elementet i existensen. Det är en luktfri, färglös, smaklös, icke-metallisk, icke-toxisk och mycket brännbar diatomisk gasformig substans med molekylformeln:. Vätgas producerades först konstgjordt under 1500-talet via den kemiska reaktionen av syror med metaller. Henry Cavendish [ 1 ] var den första som erkände vätgas som ett diskret ämne. Dessutom kan väte producera vatten när de bränns, den här egenskapen gav senare väte sitt namn: på grekiska betyder väte bokstavligen "vatten-tidigare". Det mesta av väte på jorden finns i vatten eller organiska föreningar i molekylformer. Ammoniakproduktion och bearbetning av fossilt bränsle är de viktigaste användningarna för väte, sedan används produkterna för tillverkning av kemisk gödselmedel. Inom det medicinska området används väsentligt väte före 2007. I årets Nature Medicine, en milstolpublikation av Ohsawa et al. [ 2] meddelade upptäckten av molekylär vätepotential som en ny antioxidant. De rapporterade att väte kan reducera hydroxylradikalerna selektivt och därför effektivt skydda celler. Sedan publiceringen har många studier undersökt skyddande eller gynnsamma effekter avinom olika områden, inklusive ischemi / reperfusion (I / R) skada [ [3] , [4] , [5] , [6] ], organtransplantation [ [7] , [8] , [9] , [10] ], metaboliska syndrom [ [11] , [12] , [13] ], inflammation [ [14] , [15] , [16] ] och akut strålningssyndrom [ 17 ]. Bland dem är radioskydd särskilt intressant [ 18 , 19]. För närvarande har joniserande strålning (IR) omfattande tillämpningar inom medicinsk diagnostik och tumörterapi. Många negativa effekter är avgörande kopplade till strålningsexponering.
Exponeringen för strålning genererar rikliga fria radikaler, som skadar mål som proteiner, lipider och kärnorsyror i cellerna. Fram till nu är rensningen av fria radikaler fortfarande den vanligaste accepterade radioskyddsmekanismen. Denna översyn syftar till att ge en översikt över de senaste fynden inom detta område som studerade den radioskyddande effekten av vätebehandling; med den systemiska insikten hoppas vi kunna främja ytterligare undersökningar.
2 . Biologisk bakgrund för joniserande strålning
Joniserande strålning har varit väl kopplad till olika biologiska skadliga effekter under många år. Sedan andra världskriget har riklig kunskap om strålningens biologiska effekter genererats och dokumenterats. Exponering för joniserande strålning kan leda till många faror inklusive genetiska mutationer, induktion av cellulär död och karcinogenes [ 20 ]. Bland de mest strålningskänsliga organen är det hematopoietiska systemet [ 21 , 22 ], det gastrointestinala systemet (GI) [ 23 ], det reproduktiva systemet [ 24 , 25 ] och huden [ 26 , 27 ]. Strålningsskador uppstår på cellnivå, vilket kan ske antingen direkt eller indirekt [ 28].
Strålningsenergi kan orsaka direkt skadaeffekt när den absorberas av kritiska målmolekyler, som inkluderar DNA, proteiner och andra i strålningsvägen. Exempelvis kan DNA påverkas direkt av strålningsenergi, vilket leder till att atomer i DNA-molekylen kan joniseras. Vi kan visualisera denna process som en "direkt hit" på DNA genom strålningen, och naturligtvis är detta en ganska sällsynt händelse på grund av den extremt lilla storleken på ett sådant mål: DNA-spiralen är bara cirka 2 nm i diameter. Forskningar har visat att jonisering orsakad av strålning måste ske i extrem närhet av DNA-molekylen (inom några nanometer) för att göra direkta åtgärder för att vara effektiva. Men i sådana sällsynta fall av direkt skada på DNA-molekyl, eller eventuellt någon annan cellkomponent,
Vid indirekt skada påverkar strålningen vatten och andra organiska molekyler, som i sin tur genererar fria radikaler. Dessa fria radikaler är mycket reaktiva och kan därför orsaka strukturell skada på DNA-molekyler. Sådana skador är mycket vanligare jämfört med den direkta typen. Det rapporteras att 2 Gy / fraktion av IR, en terapeutisk dos, kan orsaka cirka 3000 DNA-lesioner per cell [ 29 ]. Celler och vävnader består huvudsakligen av vatten, varför den största delen av strålningsenergi absorberas av cellvatten. Det finns en komplex serie kemiska reaktioner, som kallas vattenradiolys, i vatten efter joniserande strålningsexponering. Dessa kemiska reaktioner börjar med joniserings- och exciteringsprocess orsakad av strålning och producerande (kortlivade radikalkationer), (snabba elektroner), och (elektroniskt upphetsade vattenmolekyler). och är mycket instabila, de sönderdelas inom andra och bildar · OH- och H- fria radikaler, dessa processer illustreras enligt följande:
Det finns en oparad elektron i hydroxylradikalen, därför är det ett mycket reaktivt oxidationsmedel. Det kan diffundera ett litet avstånd och interagera med kritiska målmolekyler som genererar andra radikaler. Under tiden kan vattenmolekyler interagera med de utkastade sekundära elektronerna för att bilda hydroxyljon och väteatom. Eller genom en sekvens av reaktioner med mediet kan dessa elektroner tappa energi tills de når värmeenergier efter omkrings. Dessa termiska elektroner kan ha dielektriska interaktioner med närliggande vattenmolekyler, som löser dem att bildas, dvs. är en fri elektron omgiven av ett skikt av orienterade vattendipoler som bildar en lösningsmedelshålighet. Det kan interagera med en proton för att producera en väteatom (H ):
3 . Möjliga mekanismer för väte som radioskydd
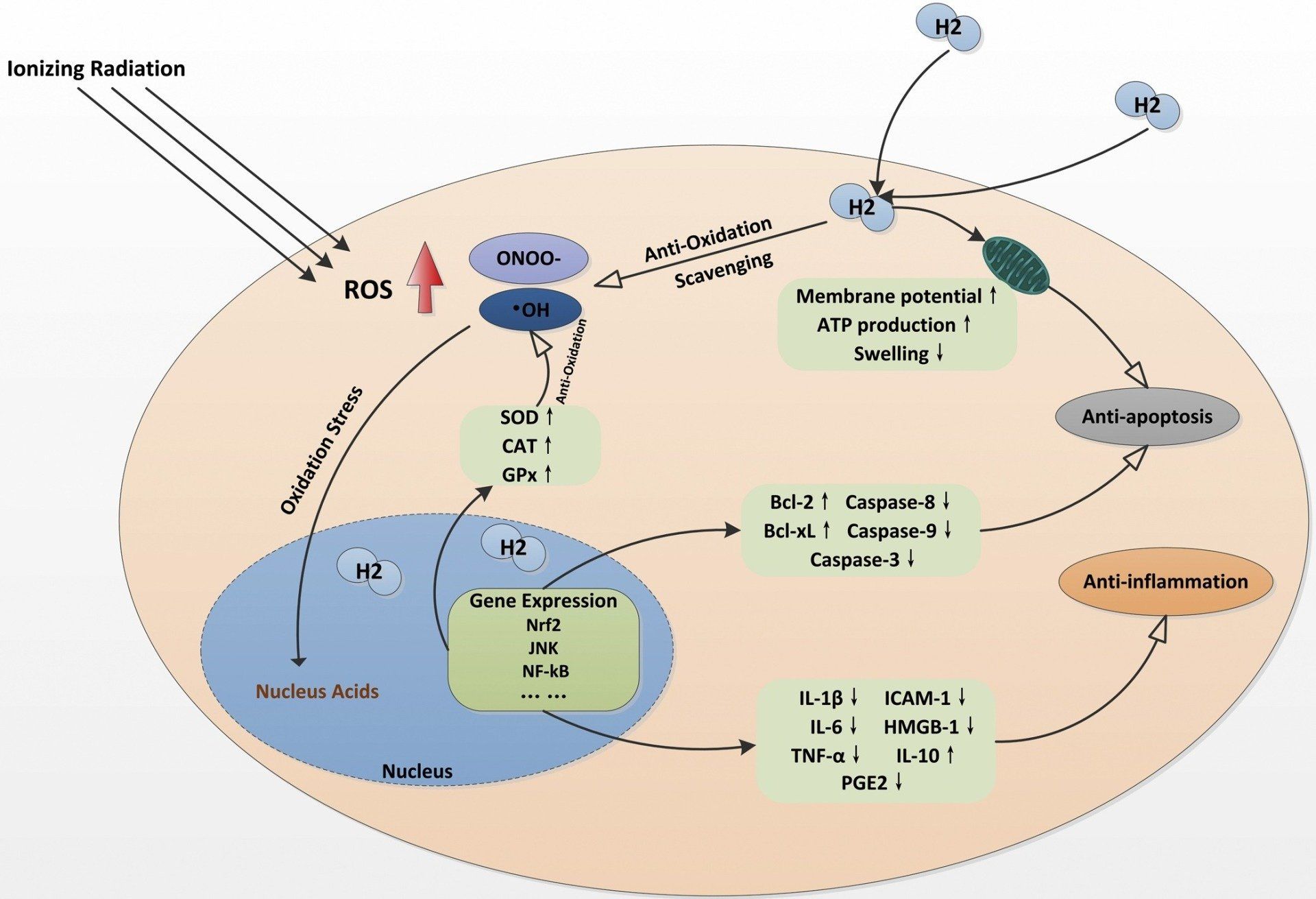
Som tidigare beskrivits attackerar joniserande strålning DNA direkt eller via radiolys av vattenmolekyler. Nya bevis visade att en betydande mängd ROS-produktion (ROS) och celltoxicitet uppstår under några timmar till år efter exponering för joniserande strålning ( Fig. 1 ). Studier hänförde dem till uppreglering av infammatoriska och fibrosmedlarande och störning av systemet med normal reduktion / oxidation (redox) [ 32 , 33]. Det är rimligt att tro att hanteringen av inflammation och oxidativ skada är en av de möjliga strategierna för att förbättra denna toxicitet efter joniserande strålning. Följaktligen fann studier att väte kan vara effektivt genom olika mekanismer för att mildra dessa effekter. Dessutom har väte flera speciella egenskaper som skulle göra det till ett idealiskt radioskyddsmedel i medicinsk användning. Dessa egenskaper inkluderar förmågan att neutralisera hydroxylradikaler ( OH) direkt i levande celler (även inkluderande penetrerande organeller som mitokondrier) [ 34 ], förmågan att korsa blod-hjärnbarriären och dess stabilitet vid rumstemperatur, också låg löslighet i vatten samt en mycket gynnsam toleransprofil [ 35 ].
Fig. 1 . Illustration av möjliga biologiska effekter av H 2. De radioskyddande effekterna av molekylärt väte är aktiva genom flera vägar, påverkar fria radikaler, inflammation, apoptos, etc.
3.1 . Avlägsna fria radikaler och antioxidation
Först antogs som en ny antioxidant, vätgas bevisades senare för dess kapacitet att rensa hydroxylradikal [ 2 , 36 , 37 ]. 2007, Ohsawa et al. [ 2 ] upptäckte det kan selektivt sänka ∙ OH och peroxynitrit () nivå i cellfria system, men förblev ganska inert gentemot resten av ROS, som innehar fysiologiska roller. I denna studie användes antimycin A, en mitokondriell respiratorisk komplex III-hämmare för att behandla odlade celler för att inducera överskottproduktion. Under sådant tillstånd, konverterades snabbt till , sedan genererad · OH. Antimycin A ökade nivåerna av och inuti celler avsevärt; medan väte upplöst i odlingsmedium hade ingen effekt på deras nivåer. Ocksåpåverkade inte stabilitetsnivån för ett annat viktigt signalmedel, NO i celler. I motsats härtill,dessutom minskade signifikant OH-nivån, som kunde detekteras genom den oxiderade formen av 2- [6- (4'-hydroxi) fenoxi-3H-xanten-3-on-9-yl] bensoat (HPF).minskade också OH-nivån, särskilt i cellkärnregionen. I den här studien, sänker signifikant · OH-nivån men ändå har liten effekt på och , som har viktiga fysiologiska roller; Därför drog de slutsatsen atthar mycket mindre negativa effekter jämfört med andra antioxidanter. Det är mycket viktigt biologiskt att eliminera OH eftersom även antioxidantförsvarsenzymer kan mildra och , dvs. av superoxid dismutase (SOD) och med peroxidas eller glutationperoxidas, finns det inget antioxidantenzym för OH.
Det diskuteras dock fortfarande om en enkel kemisk reaktion är ansvarig för denna eliminering, till exempel reaktionshastigheten på med OH ([]) är mycket långsammare än de flesta kemiska reaktioner mellan radikaler [ 38 ]. Å andra sidan förbättras uttrycket av endogena antioxidanter genom väte. En ökning av Superoxid dismutase (SOD), katalas (CAT) och glutation peroxidas (GPx) observerades vid vätebehandlingen av neurotoxicitet [ 39 ], ischemi / reperfusion [ 40 ], njurskada [ 41 , 42 ] och hypertoni [ 43 ] ]. Denna förbättringseffekt kan också vara en av orsakerna.
3.2 . Antiinflammationseffekt
Studier har illustrerat ett starkt samband mellan kronisk inflammation och oxidativ skada efter exponering för IR. Inom IR-drabbade organ ändras både antalet och funktionerna i immunsystemets celler. Som resultat inducerar ökat antal lymfocyter T (T-celler) och makrofager utsöndring av inflammatoriska mediatorer, såsom SMAD2 / 3 och kärnfaktorkappa B (NF-kB), cytokiner såsom IL-1, IL-2, IL -6, IL-8, IL-33, tumörnekrosfaktor (TNF-a), interferon gamma (IFN-y) och transformerande tillväxtfaktor beta (TGF-p). En sådan förhöjd nivå av dessa inflammatoriska mediatorer anses vara förknippad med frisättningen av prostaglandiner och fria radikaler som ROS och NO. Således kan kronisk inflammation och dess konsekvenser försämra bestrålningsorganens funktioner [ 44 , 45]. Från tidig forskning från Gharib et al., Råttor med schistosomiasis-associerad kronisk leverinflammation förvarades i en hyperbarisk kammare med 0,7 MPa väteförsörjning under två veckor. De fann minskade cirkulerande tumörnekrosfaktor-a (TNF-a). Deras experiment anses vara det första beviset på vätgas antiinflammatoriska egenskaper [ 46 ]. Efterföljande undersökningar avslöjade att nivåerna av pro-inflammatoriskt och inflammatoriskt cytokin kan minskas med gas, -saline, och -vatten. Dessa pro-in-ammatory och in-ammatory cytokin inkluderar tumornekrosfaktor-a (TNF-a), interleukin (IL) -1p, IL-6 [ 47 , 48 ], grupp med hög mobilitet 1 (HMGB-1) [ 49 ], intercellulär celladhesionsmolekyl-1 [ 49 ], prostaglandin E2 [ 50 ] och kärnfaktor kappa B (NF-kB) [ 51 ], etc. Väte fann emellertid ansvarig för att öka IL-10, ett antiinflammatoriskt cytokin av betydelse [ 52 , 53 ]. Ett annat bevis på detta område är det-vatten förbättrade signifikant symtomen på reumatoid artrit (RA) [ 54 ]. Kliniskt attackerar RA patientens ben och brosk genom kronisk inflammation.
3.3 . Anti-apoptoseffekt
Vätternas anti-apoptosegenskap är också dokumenterad i många studier av djurmodeller. De flesta av dessa resultat var antingen från TUNEL-analys eller kvantifiering av caspaser, vilket är de integrerade proteaserna i apoptos [ 6 , [55] , [56] , [57] ]. Studien visade att väte kan inducera anti-apoptotiska molekyler såsom B-cell-lymfom-extra stor (Bcl-xL) och B-cell-lymfom-2 (Bcl-2) vid lungtransplantation inducerad I / R-skada hos råttor. Dessa molekyler kan undertrycka celldöd genom apoptos [ 58 ]. Under tiden minskade uttrycket caspase-3, caspase-9 (intrinsic pathway) och caspase-8 (extrinsic pathway) [ 6]. Dessutom har studier visat att oxidativ stress också kan orsaka mitokondrier och endoplasmatisk retikulum att trigga celloptoptos. I en retinal I / R-skademodell [ 59 ], pressades Poly (ADP-ribos) -polymeras 1 (PARP-1) överaktivering och DNA-oxidation för skydd av mitokondrier genom vätebehandling. Med vätebehandling bevarades också svällningen av organellen, membranpotentialen och ATP-produktion [ 60 ].
3.4 . Reglera genuttryck
I många studier hittades en övervägande endogen antioxidativ regulator, kärnfaktor erytroid2-relaterad faktor (Nrf2), nära korrelerad till boost av SOD och CAT; medan den också är ansvarig för de cytoprotektiva effekterna. Många studier hade visat att vätgas främjar uttrycket och ökar därför kärntranslokationen av Nrf2 [ 61 , 62 ]. Nedströmseffektorer som SOD och CAT stimuleras också genom denna mekanism [ 63 ]. Nakai et al. [ 64] gjorde experimentet med att administrera molekylärt vätemättat vatten till råttor och undersökte effekterna av vätevatten på råttors levergenuttryck. Genom analys av genontologi fann man att gener för oxidoreduktionsrelaterade proteiner, såsom hydroximetylglutaryl CoA-reduktas, berikades avsevärt i de uppreglerade generna. Väte nedreglerade också kärnkraftsfaktorer inklusive c-Jun N-terminal kinase (JNK) [ 65 ], NF-KB [ 66 ], och proliferationscellekärnantigen [ 67 ].
3,5 . Möjlig signalmodulator
Det antogs att H 2 kan påverka vissa signal transduktioner genom att fungera som en indirekt modulator. Itoh et al. [ 68 ] föreslog först det, liknande kolmonoxid (CO), kväveoxid (NO) och svavelväte (), kan fungera som en gasformig signalmolekyl. Genom studier på RBL-2H3-mastceller från råtta avslöjade de att fosforylering av den FcεRI-associerade Lyn och dess nedströms signaltransduktion minskades av väte, vilket i sin tur hindrar NADPH-oxidasaktiviteten också minskar produktionen av väteperoxid.
I en annan studie på murina makrofager RAW264-celler undersökte de väteeffekterna på lipopolysackarid / interferon y-inducerad NO-produktion. Från denna studie fann de att LPS / IFNy-inducerad fosforylering av apoptos-signalreglerande kinas 1 (ASK1) förtrycktes av väte, samma effekt hittades på nedströms signalmolekyler, p38 MAP-kinas och JNK, liksom IKBa. Men väte påverkade inte genereringen av ROS och aktivering av NADPH-oxidas. Eftersom ROS är känt för att vara en uppströmsaktivator för ASK1 antyder det faktum att väte kan hämma ASK1 utan att reducera ROS att det finns en möjlig målmolekyl för väte som finns som ROS-receptorn eller sitter omedelbart nedströms ROS. Resultaten från dessa studier indikerar att molekylärt väte kan fungera som en viktig signalmodulator [69 ].
4 . Leverans av väte
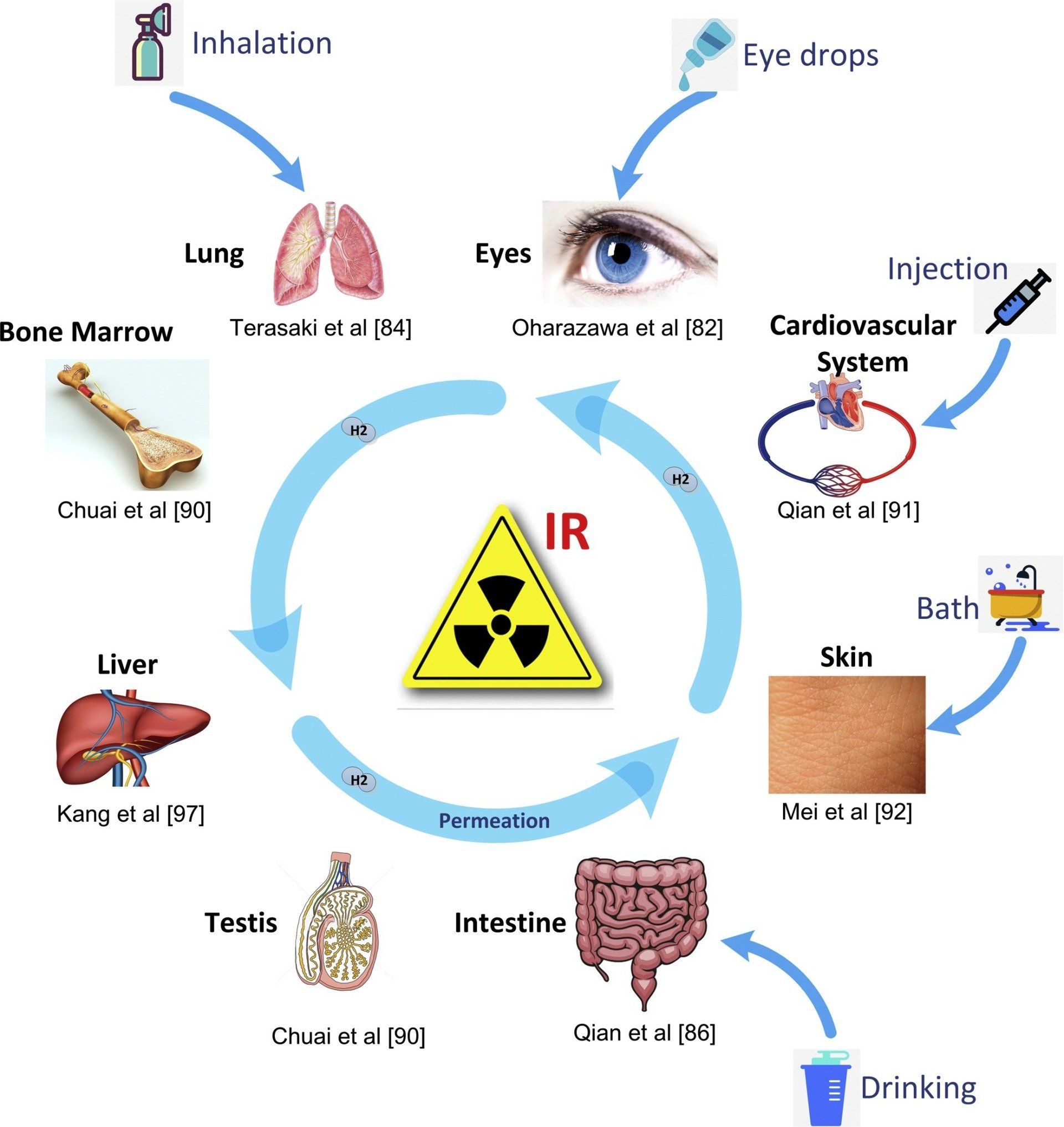
Vid kroppstemperatur är väte inte riktigt aktivt; det uppför sig ganska inert särskilt utan katalysatorer. Väte måste ha en högre temperatur än 527℃ att bli brandfarligt. Och det måste blandas väl med syre (koncentrationsintervall: 4–75%(vol / vol)) för att vara explosiv. Det är känt attproduceras inte endogent. Inget enzym relaterat till hydrasasaktivitet finns i människokroppen. Men i en mänsklig kropp kan kolonbakterierna producera cirka 12 literper dag under fysiologiska förhållanden. Således, till exempel, i en normal persons terminala andetag, koncentrationsnivån påär omkring 5-10 ppm [ 70 , 71 ]. Många forskningsresultat stöder uppreglering avgas som produceras av tarmbakterier kan användas som en giltig behandlingsstrategi för olika sjukdomar. Det finns också flera metoder för att leverera externa, såsom inandning, dricka, injektion och direkt inkorporering, etc ( Fig. 2 ).
4.1 . Inandning av vätgas
Direkt inandning är ett av de enklaste sätten att tillföra väte, till exempel tillförsel gas genom en ansiktsmask, näsekanyl eller ventilatorkrets. Det är en snabb och enkel metod. Som demonstreras av studier, 1–4% (v / v)gas som levereras genom inandning är effektiv som en behandling för I / R-skada [ 72 ]. Särskilt,inandning har ingen negativ effekt på blodtrycket [ 2 ]. För människor är säkerheten förinandning bevisas väl genom den omfattande användningen av hydreliox. Som en andningsgasblandning består hydreliox av 50% helium, 49% väte och 1% syre. Det används ofta för djupdykkomprimering för att förhindra kväve-narkos och dekompressionssjukdom [ 73 ]. Ono et al. [ 74 ] genomförde en grundläggande studie om väte () inandning för akuta patienter med cerebral ischemi. De visade att det inte finns någon negativ effekt på några fysiologiska parametrar i blodet genom inandning av 3-4% gas.
4.2 . Oral administrering av vätevatten
Även om inandning av vätgas kan träda i kraft snabbt är dricksanrikat vätgas (HW) en mer bekväm och säkrare metod som lätt kan administreras var som helst [ 75 ]. Det finns olika metoder för att producera vätgasrikt vatten: till exempel bubbla vätgas genom vatten, smälta vätgas med vatten, bryta ner vatten elektriskt och använda reaktiv metall som magnesium för att generera väte från vatten. Under normalt atmosfärstryck,gas kan löses något i vatten i upp till 0,8 mM (cirka 1,6 ppm, vikt / volym). På grund av dess extrema små molekylstorlek, penetrerar snabbt glas- eller plastväggar i alla behållare, medan aluminiumväggen kan hålla kvar gas under en relativt längre tid. I en studie av Kajiya et al. [ 76 ] observerades signifikant förbättring av symtomen på tarminflammation genom att ge väte-rika dricksvatten till möss med inflammatorisk tarmsjukdom. Det fanns också studier med vätevatten i tandvård, avslöjade resultatenatt vara effektiv vid behandling av parodontit [ 77 ].
4.3 . Injektion av väte-saltlösning
Oral administrering kan föredras för vissa på grund av dess säkerhet och bekvämlighet, men väte i vatten förångas lätt över tid, och en rättvis del av väte kommer att gå förlorad i mage eller tarm, vilket gör det mycket svårt att kontrollera nivån av administrerat väte koncentration. Injektion av väte-saltlösning kan möjliggöra exakt leverans av viss koncentration av väte. Intravenöst eller intraperitonealt injektion av-upplöst saltlösning har visat stor effekt hos modelldjur [ 78 , 79 ]. Således har denna metod tillämpats även i faktisk klinisk behandling. Det finns en open-label, nonrandomized, prospektiv studie utförd av Nagatani et al. [ 80 ]. I denna studie fick 38 patienter som var inlagda på sjukhus för akut ischemisk stroke intravenös injektion avsalin. Omedelbart efter den akuta ischemiska strokediagnosen fick alla patienterintravenös lösning. Studiedata indikerade att väte-saltlösning genom intravenös injektion är ganska säker för akuta hjärninfarktpatienter, också säkert för patienter som behandlades med vävnadsplasminogenaktivator.
4.4 . Vätebad och ögondroppar
På grund av dess extremt små molekylstorlek, kan lätt tränga in i huden och sedan cirkulera genom hela kroppen via blodflödet. I vardagen är det att ta ett bad i vatten med upplöst vätgas en metod för att införliva väte i kroppen, särskilt en ganska vanlig praxis i Japan. Det tar bara cirka 10 minuter för väte att cirkulera genom människokroppen [ 81 ].
Genom att upplösa i saltlösning förbereder forskare -anrikade ögondroppar administrerar sedan direkt dropparna till den okulära ytan [ 82 , 83 ]. Oharazawa et al. [ 82 ] rapporterade att de kontinuerligt administrerade -berikade ögondroppar under I / R-perioderna; koncentrationen ökades omedelbart i den glaskroppen, medan den I / R-inducerade OH-nivån istället minskade. Deras resultat avslöjade det -anrikade ögondroppar kan vara en mycket användbar neurobeskyttande behandling vid akut I / R-skada på näthinnan.
Även om det finns många administreringsmetoder för vätebehandling, är frågor som hur mycket väte kan absorberas genom förtäring, inandning eller injektion och hur länge det kommer att förbli effektiva ännu inte fullständigt behandlade av ytterligare undersökningar.
5 . Experiment och fynd av radioskyddande effekter
5.1 . Resultat från in vitro- studier
In vitro- studier, Terasaki et al. [ 84 ] undersökte om · OH inducerad av IR kan mildras avi levande celler. För detta ändamål bestrålade de A549-celler och bedömde celler för grön fluorescens genererad av oxiderad HPF (en markör för oxidation genomoch OH) i PBS. I kontroll-berikade PBS, de bestrålade cellerna visade ökade HPF-signaler i dessa cellers cytoplasmiska regioner. Med tillräcklig permeabilitet av cellmembran, fann studien attkan avsevärt minska HPF-signaler. Från dessa resultat föreslog de att det cellulära ROS (och OH) genererad genom bestrålning kan effektivt reduceras medi levande lungepitelceller. Under tiden,minskade signifikant nivåerna av 4-HNE (slutprodukt från lipidperoxider) och 8-OH-dG (biomarkör för oxidativ DNA-skada) i bestrålade celler. Via Western blotting, fann de att 24 timmar efter strålning, förbehandling avsignifikant minskade nivåer av apoptosrelaterade proteiner såsom caspase3 och Bax i A549-celler. De bekräftade också det effektivt kan skydda cellviabilitet.
För att testa om det väteanrikade PBS kunde användas som ett effektivt radioskyddsmedel, undersökte Qian et al. [ 85 ] designades och analyserades in vitro . Humana lymfocyt AHH-1-celler och intestinala krypt HIEC-celler behandlades med respektive volym väteanrikad PBS och bestrålades sedan med motsvarande doser av y-stråle. De fann att förbehandling av HIEC-celler med 0,1-0,4 mmol / Lföre y-strålebestrålning ökade cellöverlevnaden avsevärt jämfört med cellerna som endast behandlades med bestrålning vid alla testade doser (upp till 8 Gy). Samtidigt förbehandling medreducerade drastiskt LDH-läckaget av HIEC-celler, sådana data var i linje med upptäckten från cellvårighetsundersökningen. Antalet apoptotiska celler sjunker till 26,1% jämfört med 49,3% i kontrollgruppen, sådana resultat från HIEC-celler som förbehandlats med väteanrikad PBS visade tydligt den skyddande effekten av väte. Medan för AHH-1-celler ökades nivåerna av både icke-enzymatisk antioxidant (GSH) och enzymatiska antioxidanter (SOD) i väteanrikad PBS förbehandlad grupp, vilket återställde antioxidantstatusen.
Dessa data in vitro visade detbehandling kan rensa ROS och skydda mot apoptotisk skada relaterad till IR-inducerad oxidativ stress. Den återställda antioxidantstatusen kan också mildra attacken av fria radikaler på biomolekyler som DNA och membranlipider, och därigenom ytterligare minska de skadliga effekterna av strålning på celler.
5.2 . Resultat från in vivo- studier
In vivo- studier, Terasaki et al. [ 84 ] använde en musmodell med lungskada från bestrålning för att utvärderabehandling genom inandning under bestrålningsperioden; dricka sedan-berikat vatten efter bestrålning. Under den akuta fasen av skada (inom 1 vecka efter bestrålningen), möss medbehandling visade signifikant mindre mängd alveolära celler som testades positivt för TUNEL-färgning (markörer för apoptos) och 8-OH-dG. Efterbehandling i lungvävnad från möss, nivåer av Bax, den profibrotiska cytokinen TGF-p1, MDA (en markör för lipidperoxidation) och Bax mitokondriell translokation minskades också drastiskt. Därefter undersökte de sena skadorna (5 månader efter bestrålning) med mikro-CT i bröstet. Bestrålade möss utan behandling hade en framträdande ökning av det radioöppna området som avslöjade lungskador, men möss med behandling visade betydligt mindre skador. Genom immunohistologisk analys bevisade denna studie också att möss medbehandlingen hade mycket mindre fibrotiska förändringar inom det alveolära området. Från dessa resultat,behandling in vivo visade sig kunna undertrycka akut IR-inducerad skada, mildra oxidativ stress och efterföljande längre tids fibrotisk skada av lungor hos möss.
Qian et al. [ 86 ] undersökte tarmskador behandlade med väteanrik saltlösning. Histologiska joniserande strålningsskador observerades hos manliga BALB / c-råttor. Skadorna kännetecknades av framträdande slemhinneintrofilinfiltrering, förlust av villous epitel och förkortning av villi. Genom att administrera väterik saltlösning förbättrades alla dessa fenomen. Studien avslöjade också en avsevärd ökning av halterna av icke-enzymatisk antioxidant (GSH), enzymatisk antioxidant (SOD) och en minskning i halterna av intestinal 8-OH-dG och plasma MDA i behandlingsgrupp.
Joniserande strålning är särskilt skadligt för spermatogenesen; även mycket låg dos som 0,1 Gy är känd för att vara skadlig för spermatogonia [ 87 , 88 ]. Det hematopoietiska systemet är också välkänt för sin känslighet för joniserande strålning. Myelosuppression har alltid varit ett avgörande problem för individer som utsätts för joniserande strålning [ 89 ]. För att ta reda på ombehandlingen är effektiv för att skydda hematopoies och spermatogenes från IR-inducerade skador, möss behandlades med antingen väterik saltlösning eller fysiologisk saltlösning intraperitonealt 5 minuter före strålning. Resultat från denna studie visade att behandling av möss före IR-exponering medkan effektivt skydda seminiferous epitel och öka spermatidhuvudräkningen. En ökning av SOD- och GSH-nivåerna observerades återställande av testikelantioxidantstatus. Samtidigt reducerades cytotoxiska produkter såsom MDA, proteinkarbonyl och 8-OH-dGbehandlade möss. Kvantitativ analys för spermatogoni och spermatocyter avslöjade att de apoptotiska fynden ibehandlade grupper var betydligt mindre än hos kontrollgrupper. De fastställde också detförbehandling kan drastiskt öka antalet PB-leukocyter, BMNC och endoCFUs [ 88 , 90 ].
IR är också skadligt för hjärtat. Bestrålning kan leda till nedsatt funktion av kronisk hjärtpump och annan hjärtsjukdom. En annan studie från Qians grupp [ 91 ] testade om IR-inducerad skada som leder till myokarddegeneration kan mildras med vätebehandling. I denna studie, möss utan förbehandling före 7 Gy hela kroppens y-bestrålning hade 90% dödlighetsgrad den 13: e dagen, medan i jämförelse 80% av mössen med förbehandling av överlevde till det skedet. Vid 4 timmar efter y-bestrålning, totala GSH-koncentrationer och myocardial SOD igruppen var betydligt högre än hos kontrollgruppen. Även 8-OH-dG-koncentrationer och myocardial MDA-nivåer var mycket lägre i grupp.
Radiodermatit är en av biverkningarna av strålterapi, särskilt vanligt vid behandling av huvud- och nackcancer. Mei et al. [ 92 ] analyserade den radioskyddande effekten av väte för dermatit orsakad av lokal strålning hos råttor. Råttor fick antingen fraktionerad eller enkeldos bestrålning i huvud-och-hals-området studerades med eller utan injektion av vätelösning före bestrålning. De fann att koncentrationen av SOD och GSH i plasma var signifikant högre i vätegruppen, medan nivån av plasma-MDA var mycket lägre jämfört med kontrollgruppen. Väte minskade signifikant svårighetsgraden av dermatit och hjälpte vävnadsåterhämtning hos råttor.
Som en av de viktigaste försvarsmekanismerna fungerar immunsystemet mot olika miljömedel inklusive joniserande strålning. Genom långtidsstudier av epidemiologi fann forskare att en nedsatt immunrespons kunde orsakas av joniserande strålning (dosberoende). Dessutom kan joniserande strålning leda till en beständig inflammatorisk status [ 93 , 94 ]. Zhao et al. [ 95 ] genomförde en studie för att utvärdera vätgas radioskyddande effekter på immunsystemet från möss. Efter bestrålning av hela kroppen minskade andelen apoptotiska splenocyter särskiltbehandlingsgrupp. För att undersöka väteets skyddande effekt på IR-inducerad immunsjukdom mättes andelen CD4 + och CD8 + och det totala antalet splenocyter. Både andelen CD4 + och CD8 + och det absoluta antalet splenocyter i kontrollgruppen var märkbart lägre än de ibehandlingsgrupp. CD4 + -celler består av Treg, Th1, Th2 och Th17. Studiens resultat avslöjade att väte kan motverka uppreglering av Treg, Th2 och Th17, nedreglering av Th1, båda orsakade av IR. Nio cytokiner av elva (TNF-a, GM-CSF, IL-4, IL-5, IL-10, IL-1b, IL-17, IL-23, transformerande tillväxtfaktor (TGF) -b1) höjdes drastiskt i strålningsgrupp, jämfört med normal grupp. Under tiden nivåerna ibehandlingsgruppen reducerades jämfört med strålningsgruppen. I strålningsgruppen minskades också IL-12 och IFN-c, men båda förbättrades till nästan normala nivåer i behandlingsgrupp.
Joniserande strålning anses vara ett komplett cancerframkallande ämne, som kan både initiera och främja tumörprogression. Den senaste studien upptäckte detkan skydda BALB / c-möss mot IR-inducerat tymiskt lymfom. I denna studie var den strålningsinducerade tymiska lymfomhastigheten betydligt lägre ibehandlingsgrupp. Dessutom fanns det en mycket större latens för lymfomutveckling i denna grupp [ 96 ].
Alla dessa studieresultat presenterade den potentiella skyddande effekten av väte. Den specifika regleringsmekanismen och / eller signalvägen för vätemolekyl är emellertid fortfarande relativt vaga. Mycket fler reaches är nödvändiga för att antaga mer insiktsfulla modeller, för att belysa detaljerade mekanismer och för att verifiera omfattningen av effektiviteten.
5.3 . Klinisk praxis
Även om massor av undersökningar har gjorts för att avslöja potentialen för väte som radioskydd, både in vitro- och vivo- studier. Det fanns knappa data om klinisk praxis. Kang et al. [ 97] utförde en placebokontrollerad, slumpmässig studie för att utvärdera giltigheten för intagande av väterikt vatten på 49 patienter med maligna levertumörer, medan de fick strålbehandling. I den här studien placerade de metallisk magnesiumpinne i dricksvatten för att producera väterikt vatten (stabil vätekoncentration: 0,55-0,65 mM) Efter att ha drickat väterikt vatten i 6 veckor fann studien lägre nivå av reaktiva syremetaboliter i blodet, medan bibehållande av blodoxidationspotential. Patienter som drickade vätetrikt vatten hade betydligt högre livskvalitet (QOL) än patienter som drickade placebovatten under strålbehandling. Även patienter som behandlats med väterikt vatten upplevde särskilt mindre aptitförlust och mycket färre smakproblem. Mellan de två grupperna det fanns ingen skillnad angående tumörrespons på strålbehandling. Även om den totala överlevnadshastigheten för patienter med maligna tumörer bör vara onkologernas främsta oro, bör överlevnad också tolkas med hänsyn till symptompallering och total QOL. Med tanke på detta, på grund av vätgas mycket låga toxicitet och mycket låga chans att hindra tumörkontroll, kommer regelbunden leverans av vätevatten som ett lovande tillvägagångssätt för att lindra IR-inducerad försämring till QOL. Ytterligare studier är motiverade för att belysa säkerheten för väterikt vatten och bestämma den optimala koncentrationen av väte i dricksvatten. överlevnad bör också tolkas med hänsyn till symptompalliation och total QOL. Med tanke på detta, på grund av vätgas mycket låga toxicitet och mycket låga chans att hindra tumörkontroll, kommer regelbunden leverans av vätevatten som ett lovande tillvägagångssätt för att lindra IR-inducerad försämring till QOL. Ytterligare studier är motiverade för att belysa säkerheten för väterikt vatten och bestämma den optimala koncentrationen av väte i dricksvatten. överlevnad bör också tolkas med hänsyn till symptompalliation och total QOL. Med tanke på detta, på grund av vätgas mycket låga toxicitet och mycket låga chans att hindra tumörkontroll, kommer regelbunden leverans av vätevatten som ett lovande tillvägagångssätt för att lindra IR-inducerad försämring till QOL. Ytterligare studier är motiverade för att belysa säkerheten för väterikt vatten och bestämma den optimala koncentrationen av väte i dricksvatten.
6 . Slutsats och framtida riktningar
Det har alltid varit en stark efterfrågan på säkra och potenta radioskyddsmedel. Det enda amerikanska FDA-godkända radioskyddsmedlet som finns tillgängligt idag är den syntetiska tiolamifostinen [ 98 , 99 ]. Det har emellertid många brister, såsom kort skyddstid, ogynnsamma administreringsvägar och relativt hög toxicitet. Naturliga antioxidanter som melatonin, E-vitamin och andra, samtidigt som de har färre negativa effekter, erbjuder de också mycket svagare skydd jämfört med tiolmedel [ [100] , [101] , [102] ].kan enkelt appliceras med små negativa effekter och stor effektivitet som ett potentiellt radioskyddsmedel. Den här artikeln granskade uppdaterad medicinsk utveckling relaterad tillsom radioskyddsmedel som täcker dess unika egenskaper, potentiella verkningsmekanismer, leveransmetoder, fynd in vitro / vivo- studier till och med klinisk praxis. Till skillnad från många djurmodellundersökningar fanns det dock mycket få kliniska prövningar förtillämpningar. Därför är storskaliga, framtida, väl utformade kliniska studier mycket nödvändiga för att optimerados, timing och leveransmetoder. Dessutom molekylära mekanismer föroch dess primära molekylära mål är fortfarande oklara.
Vi har en verklig önskan att se både forskare och kliniker utöka och fördjupa vår förståelse för denna anmärkningsvärda gasmolekyl i framtiden.
Läs studien i sin helhet:
https://www.sciencedirect.com/science/article/pii/S0753332220307824